Aufgabe 9
Aufgabe I/1:
1 50 ml einer wässrigen Lösung von Methansäure
(Ameisensäure) werden mit Natronlauge (c(NaOH) = 1 mol . l–1
) titriert.
Nach Zugabe von genau 10 ml dieser
Natronlauge ist der Äquivalenzpunkt erreicht und damit die
Titration beendet.
1.1 Formulieren Sie die
Reaktionsgleichung.
Berechnen Sie die Konzentration der
Methansäurelösung in mol * l–1
und ihren pH-Wert.
1.2 In welchem Bereich liegt der
pH-Wert der Lösung am Äquivalenzpunkt?
Welchen Indikator
würden Sie für diese Titration wählen?
Begründen Sie Ihre
Angaben.
2 Ethanol und Methansäure (je 1 mol) reagieren miteinander protonenkatalysiert zu Ester und Wasser. Um den Ablauf der Reaktion zu verfolgen, werden dem Reaktionsgemisch, dessen Temperatur konstant gehalten wird, zu bestimmten Zeiten Proben entnommen und deren Gehalt an Methansäure bestimmt. Dabei werden folgende Werte ermittelt:
| Probenentnahme nach | 0,5 min | 1 min | 2 min | 4 min | 10 min | 300 min | 600 min |
| Konzentration der Methansäure in mol * l-1 | 9,3 | 9,0 | 8,7 | 8,3 | 7,5 | 4,55 | 4,55 |
Die bei der Reaktion auftretende geringe Volumenänderung ist zu vernachlässigen.
2.1 Formulieren Sie die Reaktionsgleichung für diese Esterbildung unter Verwendung von Strukturformeln mit bindenden und nichtbindenden Elektronenpaaren.
2.2 Berechnen Sie mit Hilfe der Dichten (Ethanol : 0,79 g . cm–3, Methan-säure: 1,22 g . cm–3) die Konzentrationen der Ausgangsstoffe im Reaktionsgemisch zu Beginn der Reaktion in der Einheit mol . l–1.
2.3 Wie groß ist die durchschnittliche Reaktionsgeschwindigkeit der Esterbildung zwischen der zweiten und der vierten Minute?
2.4 Berechnen Sie die Konzentration des Esters im Gleichgewichtszustand und die Gleichgewichtskonstante Kc.
Aufgabe I/2:
Wichtige Derivate des Benzols sind Phenol und Styrol.
1 Geben Sie für diese Derivate die Strukturformeln an.
(Bei den Substituenten sind die bindenden und nichtbindenden
Elektronenpaare anzugeben.)
Bei Zimmertemperatur ist
Phenol im Gegensatz zu Styrol fest.
Geben Sie dafür eine
Erklärung.
2 Beim Schütteln von Phenol bzw. Styrol mit Natronlauge
reagiert nur eines dieser Benzolderivate.
Stellen Sie
dafür eine Reaktionsgleichung auf.
3 Sowohl Phenol als auch Styrol reagieren bei
Zimmertemperatur mit Brom.
3.1 Formulieren Sie die
Reaktionsgleichung für die Reaktion von Styrol mit Brom und
nennen Sie den Reaktionstyp.
Formulieren Sie die
einzelnen Schritte des Reaktionsmechanismus.
3.2 Das zur
Bromierung von Phenol benötigte Brom kann in saurer
wässriger
Lösung aus Kaliumbromid und Kaliumbromat (KBrO3)
hergestellt werden.
Stellen Sie hierfür eine
Reaktionsgleichung auf.
3.3 Um nachzuprüfen, ob Phenol
mehrfach bromiert wird, werden in einer sauren wässrigen
Lösung 0,15 g Phenol nach obigem Verfahren unter Verwendung
von n = 0,002 mol Kaliumbromat bromiert. Nach der Reaktion
stellt man durch Titration fest, dass 0,0012 mol Brom übrig
blieben.
Berechnen Sie die umgesetzte Stoffmenge Brom und
formulieren Sie die sich ergebende Reaktionsgleichung der
Bromierung.
Aufgabe II/1:
Wichtige Ausgangsstoffe zur Herstellung von Kunststoffen
sind:
(A) cis-Butendisäure (Maleinsäure)
(B)
1,6-Diaminohexan (Hexamethylendiamin)
(C) 1,4-Butandiol
(D) Phenylethen (Styrol)
(E) 1,2,3-Propantriol (Glycerin)
(F) Phenylen-1,4-diisocyanat
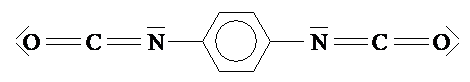
1 Geben Sie die Strukturformeln der Moleküle der
Verbindungen (A) bis (E) mit bindenden und nichtbindenden
Elektronenpaaren an.
2 Je zwei der Stoffe (A) bis (F) sollen zur Herstellung
von Kunststoffen verwendet werden.
Geben Sie an, mit
welchen Stoffen
(a) ein thermoplastischer Polyester,
(b) ein thermoplastisches Polyamid,
(c) ein
thermoplastisches Polyurethan
hergestellt werden könnte.
Zeichnen Sie jeweils einen Formelausschnitt, der den Aufbau
des Makromoleküls erkennen lässt.
3 Einer der gemäß Aufgabe 2 herstellbaren Kunststoffe
soll unter Verwendung von Styrol zu einem Duroplast
weiterverarbeitet werden.
Wählen Sie diesen Kunststoff
aus und begründen Sie Ihre Wahl.
Nennen Sie einen
möglichen Reaktionsmechanismus für diese Reaktion und
erläutern Sie, wie die Reaktion in Gang gesetzt werden kann.
4 Je zwei Stoffe (A) bis (F) sollen zur Herstellung von
duroplastischen Kunststoffen verwendet werden.
Geben Sie
zwei Möglichkeiten an.
Aufgabe II/2:
1 Phosphorsäure (H3PO4)
lässt sich durch Verbrennen von Phosphor an der Luft und
anschließende Umsetzung des gebildeten Phosphor(V)-oxids mit
Wasser gewinnen.
1.1 Formulieren Sie für die beiden
Umsetzungen Reaktionsgleichungen, und entscheiden Sie, ob es
sich dabei um Redoxreaktionen handelt.
Begründen Sie Ihre
Entscheidung.
1.2 Aus Phosphor(V)-oxid und Wasser soll
eine Phosphorsäurelösung mit dem Volumen V = 1 l und dem
Massenanteil w(H3PO4)
= 85 % hergestellt werden. Die Dichte dieser Lösung beträgt
ρ = 1,687 g · cm–3.
Berechnen Sie die Masse der Stoffportion m(Phosphor), die
hierfür verbrannt werden muss.
2 Phosphorsäure ist
eine dreiprotonige Säure. Im folgenden soll nur die erste
Protolysestufe berücksichtigt werden.
2.1 Formulieren Sie
die Reaktionsgleichung für die Protolyse der Phosphorsäure.
Berechnen Sie näherungsweise den pH-Wert einer
Phosphorsäurelösung der Stoffmengenkonzentration c = 0,15
mol · l–1.
a) unter der Annahme, Phosphorsäure sei eine
starke Säure, und
b) unter der Annahme, Phosphorsäure sei
eine schwache Säure.
Erläutern Sie, wie Sie feststellen
können, welche der Annahmen realistischer ist.
2.2
Bei einer Titration wird Phosphorsäure mit Natronlauge zu
Natriumdihydrogenphosphat umgesetzt.
Für V1 = 40 ml
einer Phosphorsäureprobe benötigt man V2 = 12 ml einer
Natronlauge der Stoffmengenkonzentration c = 0,5 mol · l–1.
Berechnen Sie die Stoffmengenkonzentration dieser
Phosphorsäurelösung.
3 Beschreiben Sie einen experimentellen Nachweis für Phosphat-Ionen.
4 Das
Düngemittel Superphosphat, ein Gemisch aus
Calciumdihydrogenphosphat und Calciumsulfat, wird durch
Umsetzung des in der Natur vorkommenden Calciumphosphats
mit Schwefelsäure hergestellt.
Geben Sie hierzu eine
Reaktionsgleichung an.
Erläutern Sie die Belastung der
Umwelt durch phosphathaltige Düngemittel.
Aufgabe III/1:
Der makromolekulare Stoff Murein ist eine Gerüstsubstanz
in Bakterienzellwänden. Bei seiner Hydrolyse erhält man
unter anderem folgende Bausteine:
D-Alanin,
L-Alanin, D-Glutaminsäure, L-Lysin sowie
D-Glucosamin.
Beim D-Glucosamin ist die
Hydroxylgruppe am Kohlenstoffatom 2 der D-Glucose durch eine
Aminogruppe ersetzt.
1 Geben Sie die Strukturformeln der
vier genannten Aminosäuren an.
2 Nennen und erläutern Sie ein Verfahren zur Trennung und Identifizierung von Aminosäuren.
3 In Tabellenwerken werden für die Glutaminsäure drei
unterschiedliche pKS-Werte
angegeben:
pKS1
= 2,1 pKS2 = 4,3
pKS3 = 10,0
Ihnen entsprechen drei aufeinanderfolgende
Protolysengleichgewichte.
Formulieren Sie für diese
Gleichgewichte jeweils eine Reaktionsgleichung.
Ordnen
Sie die angegebenen pKS-Werte den Protolysengleichgewichten
zu, und begründen Sie.
4 Geben Sie für das oben genannte Hydrolyseprodukt D-Glucosamin die Strukturformel in der Fischer-Projektion und in der Schreibweise nach Haworth an.
5 Die Silberspiegelprobe verläuft mit Glucosaminen
positiv.
Beschreiben Sie die Durchführung dieser
Nachweisreaktion, und formulieren Sie die zugehörige
Reaktionsgleichung.
6 Die α-Form des D-Glucosaminmoleküls wird
1,2-glykosidisch mit einem β-D-Fructosemolekül verknüpft.
Geben Sie für das Verknüpfungsprodukt die Strukturformel in
der Haworth-Schreibweise an.
Begründen Sie, ob auch mit
diesem Produkt die Silberspiegelprobe positiv verläuft.
Aufgabe III/2:
1 Die Ölsäure (9-Octadecensäure, C17H33COOH)
lässt sich aus Fetten und Ölen herstellen. Die im
Ölsäuremolekül enthaltene Doppelbindung zwischen zwei
Kohlenstoffatomen kann durch Reaktion mit Brom nachgewiesen
werden.
1.1 Geben Sie für diese Reaktion von Brom mit
Ölsäure eine Reaktionsgleichung unter Verwendung von
Summenformeln an.
Formulieren Sie den Reaktionsmechanismus für die Reaktion
von Brom mit einer C-C-Doppelbindung.
1.2 Das für die
Reaktion mit Ölsäure benötigte Brom kann hergestellt werden,
indem man Kaliumbromid zu einer angesäuerten
Kaliumbromatlösung (KBrO3)
gibt.
Geben Sie für diese Reaktion eine
Reaktionsgleichung an, und zeigen Sie, dass es sich um eine
Redoxreaktion handelt.
1.3 Zu einer angesäuerten
Kaliumbromatlösung werden V = 5 ml Ölsäure der Dichte ρ =
0,89 g · ml–1 gegeben. Diese Lösung wird mit einem
Überschuss
an Kaliumbromid versetzt. Das entstehende Brom soll
vollständig umgesetzt werden.
Berechnen Sie die Masse m
der Stoffportion Kaliumbromat, die dafür in der Lösung
enthalten sein muss.
1.4 Eine wässrige Lösung
von Natriumoleat, dem Natrium-Salz der Ölsäure, ist
waschaktiv, reagiert nicht neutral und bildet mit hartem
Wasser einen Niederschlag.
Erklären Sie diese drei
Eigenschaften, und geben Sie für die beiden letztgenannten
jeweils eine Reaktionsgleichung an.
2 Moderne
Waschmittel können als waschaktive Substanz
4-Dodecylbenzolsulfonat enthalten.
Für seine Herstellung
wird in einer Reaktion (A) zunächst n-Dodecan (12 C-Atome)
mit Chlor zu 1-Chlordodecan umgesetzt.
In einem zweiten,
durch Aluminiumchlorid katalysierten Schritt (B) reagiert
das organische Produkt mit Benzol zu Dodecylbenzol und
Chlorwasserstoff.
Danach wird das Dodecylbenzol
sulfoniert (Reaktion C).
Durch Zugabe von Natronlauge
(Reaktion D) erhält man schließlich das gewünschte
4-Dodecylbenzolsulfonat.
2.1 Geben Sie für die Reaktionen
(A) bis (D) jeweils eine Reaktionsgleichung an.
2.2
Formulieren Sie für den Reaktionsschritt (C) ausführlich den
Reaktionsmechanismus.
Aufgabe IV:
1 Reines Kupfer ist ein guter elektrischer Leiter.
Erklären Sie diese Eigenschaften mit Hilfe eines Modells für
die Bindungsverhältnisse in einem Metall.
2 In der Natur kommt Kupfer hauptsächlich in Form von
sulfidischen Erzen vor, z. B. als Kupferglanz
(Kupfer(I)-sulfid). Zur Gewinnung von Rohkupfer wird ein
Teil des Kupferglanzes zunächst zu rotem Kupfer(I)-oxid
geröstet. Dieses wird anschließend mit weiterem Kupferglanz
erhitzt.
2.1 Formulieren Sie für die beiden Schritte des
Verfahrens jeweils die Reaktionsgleichung.
2.2 Wie viel
Rohkupfer kann man aus einer Stoffportion Kupferglanz der
Masse m = 10 t erhalten, und wie groß muss die Stoffportion
Kupferglanz sein, die davon im ersten Schritt geröstet wird?
3 Das so erhaltene Rohkupfer enthält noch
Verunreinigungen wie z. B. Silber, Gold, Eisen und Zink.
Diese Verunreinigungen werden durch elektrolytische
Raffination entfernt.
3.1 Erstellen Sie eine beschriftete
Skizze für dieses Verfahren.
3.2 Erläutern und begründen
Sie die Vorgänge an den Elektroden.
4 Ein einfaches Verfahren zur Herstellung von
Leiterplatten für elektronische Geräte besteht darin, dass
auf einer mit Reinkupfer beschichteten Kunststoffplatte die
zukünftigen Leiterbahnen durch einen Schutzlack abgedeckt
werden und das ungeschützte Kupfer in einem Ätzbad durch
Oxidation in Lösung gebracht wird.
4.1 Zeigen Sie mit
Hilfe der Normalpotentiale, dass eine Lösung von
Eisen(III)-chlorid als Ätzbad verwendet werden kann.
Formulieren Sie hierzu eine Reaktionsgleichung.
4.2 In
einem frischen Ätzbad ist die Konzentration an
Eisen(III)-chlorid c = 2 mol · l-1
.
Nachdem einige Leiterplatten geätzt worden sind,
beträgt die Konzentration der Eisen(III)-ionen c(Fe3+)
= 0,2 mol · l-1
und die Konzentration der Kupfer(II)-ionen c(Cu2+)
= 0,9 mol · l-1.
Entscheiden Sie anhand einer Rechnung, ob in diesem Bad noch
weitere Leiterplatten geätzt werden können.
Lösung(BW97)
