Aufgabe 15
Aufgabe I:
1 Die qualitative Elementaranalyse einer Verbindung X
ergibt, dass in ihren Molekülen Kohlenstoff-, Wasserstoff-,
Stickstoff- und Sauerstoff-Atome gebunden sind. Bei der
vollständigen Oxidation von 122,0 mg der Verbindung X
entstehen 84,6 mg Wasser und 155,1 mg Kohlenstoffdioxid. Der
Stickstoffanteil der Verbindung X wird in einem weiteren
Analyseschritt in elementaren Stickstoff übergeführt; bei
der Einwaage von 115,0 mg der Verbindung X entstehen 24,7 ml
Stickstoff (Normzustand).
Berechnen Sie die empirische
Formel (Verhältnisformel) der Verbindung X!
Der Gang der
Berechnung muss klar ersichtlich sein.
2 Die physikalisch-chemischen Eigenschaften von
Alkansäuren werden im wesentlichen durch ihre funktionellen
Gruppen und deren Position im Molekül bedingt.
2.1
Zeichnen Sie die Strukturformeln aller Isomeren von
Monochlorpropansäure, und benennen Sie diese!
2.2 Die
Isomeren von Monochlorpropansäure können durch ein optisches
Meßverfahren unterschieden werden.
Beschreiben Sie das
Prinzip dieser Analysemethode, und vergleichen Sie das
Verhalten der Isomeren!
2.3 Vergleichen Sie die
Säurestärke von Propansäure mit den Säurestärken
a) von
2-Chlorpropansäure und
b) von Butansäure!
Begründen
Sie die Unterschiede!
2.4 Propansäure soll in
säurekatalysierter Reaktion mit Methanol umgesetzt werden.
Beschreiben Sie unter Mitverwendung von Strukturformeln den
Mechanismus dieser Reaktion!
3 Aminosäuren sind die Bausteine von Peptiden und
Proteinen.
3.1 Ordnen Sie den beiden Aminosäuren Alanin
(2-Aminopropansäure) und Asparaginsäure
(2-Aminobutandisäure) die isoelektrischen Punkte (IEP) 2,77
bzw. 6,00 zu, und begründen Sie Ihre Entscheidung!
3.2
Beschreiben Sie unter Mitverwendung einer beschrifteten
Skizze, wie man ein Gemisch der unter Nr. 3.1 gegebenen
Aminosäuren durch Elektrophorese trennen kann!
3.3 Durch
Reaktion zwischen Alanin (Ala) und Serin
(2-Amino-3-hydroxypro-pansäure; Ser) entstehen verschiedene
Tripeptide.
3.3.1 Formulieren Sie in Kurzschreibweise
(ohne Formeln) die aufgrund unterschiedlicher Sequenzen
möglichen Isomeren! (Stereoisomere sind nicht zu
berücksichtigen.)
3.3.2 Schreiben Sie für ein Isomer die
Strukturformel!
4 Ein modernes Sporthemd besteht aus zwei Gewebelagen,
einer inneren netzartigen Schicht aus Polypropen und einer
äußeren Schicht aus Baumwolle. Dadurch soll Schweiß von der
Haut weggeführt werden.
4.1 Zeichnen Sie je einen
kennzeichnenden Strukturformelausschnitt der Makromoleküle
Polypropen und Cellulose!
4.2 Erklären Sie, wie der
Aufbau des Sporthemds und die unterschiedlichen
Eigenschaften der beiden makromolekularen Stoffe zum
wasserableitenden Effekt führen!
4.3 Erörtern Sie, ob ein
derartiges Sporthemd bei 90 °C gewaschen werden darf!
Aufgabe II:
1 Kekulé schlug 1865 für das Benzolmolekül eine heute
nach ihm benannte Strukturformel vor, die Benzol als
Cyclohexatrien beschrieb. Hätte das Benzol-Molekül jedoch
diese Kekulé-Struktur, müsste bei der Totalhydrierung eine
Enthalpie von ca. 360 kJ /mol frei werden. Tatsächlich misst
man aber eine Hydrierungsenthalpie von etwa 209 kJ /mol.
1.1 Erklären Sie den Unterschied zwischen erwartetem und
gefundenem Wert der Hydrierungsenthalpie!
1.2 Sowohl
Benzol als auch Phenol können nitriert werden.
1.2.1
Benennen und formulieren Sie unter Mitverwendung von
Strukturformeln den Mechanismus der Nitrierung von Benzol
bis zum Nitrobenzol!
1.2.2 Während sich Phenol leicht zu
Trinitrophenol nitrieren lässt, führt die Nitrierung von
Benzol nur unter Extrembedingungen zu Trinitrobenzol.
Erklären Sie das unterschiedliche Reaktionsverhalten der
beiden Edukte!
1.2.3 Phenol und 2,4,6-Trinitrophenol
unterscheiden sich erheblich in der Säurestärke.
Ordnen
Sie die pKs-Werte 0,22 und 9,98 den Verbindungen zu, und
begründen Sie die Zuordnung!
2 Die Fehling-Probe ist ein häufig verwendeter Nachweis
der leichten Oxidierbarkeit bestimmter organischer Stoffe.
In getrennten Versuchen wird mit den vier folgenden
Verbindungen die Fehling-Probe durchgeführt:
a) Hexanal;
b) 2-Hexanon (Hexan-2-on);
c) Glucose;
d)
1-Hydroxy-2-hexanon (1-Hydroxyhexan-2-on).
2.1 Erläutern
Sie unter Mitverwendung der Strukturformeln der genannten
Verbindungen die Ergebnisse der vier Fehling-Proben!
2.2
Formulieren Sie ohne Berücksichtigung der Komplexbildung die
Redoxgleichung für eine positiv verlaufende Fehling-Reaktion
der Aufgabe 2.1!
3 Kohlenhydrate dienen vielen Lebewesen als ergiebige
Energiequelle.
3.1 Formulieren Sie unter Mitverwendung
von Strukturformeln die Abschnitte des Glucoseabbaus, die
bei der Zellatmung und der Milchsäuregärung identisch sind!
Beteiligte Coenzyme sind in der üblichen Kurzschreibweise
anzugeben.
3.2 Nennen Sie die Reaktionsabschnitte, die
sich bei der Zellatmung an den unter Nr. 3.1 beschriebenen
Abbauprozess anschließen!
Geben Sie die Bedeutung der
einzelnen Abschnitte für den Energiegewinn der Zelle an!
4 Kernreaktoren tragen in Industriestaaten zur Deckung
des Energiebedarfs bei.
4.1 Beschreiben Sie kurz den
Aufbau eines Spaltungsreaktors, und erläutern Sie die
Bedeutung der wesentlichen Bestandteile!
4.2
Strontium-90, das sich in relativ großer Menge im
radioaktiven Abfall von Kernkraftwerken findet, kann
anstelle von Calcium in das Knochengerüst des Menschen
eingebaut werden und dort zerfallen. Von 1,000 mg des
Nuklids Sr-90 sind nach zwei Jahren 0,047 mg zerfallen.
Berechnen Sie die Halbwertzeit von Sr-90! Der Gang der
Berechnung muss klar ersichtlich sein.
4.3 Die
Halbwertzeit eines Kohlenstoff-Isotops beträgt 5 730 Jahre.
Dieses Isotop wird in der Archäologie für Altersbestimmungen
kohlenstoffhaltiger Funde genutzt.
Erläutern Sie das
Prinzip dieser Methode, und legen Sie dar, warum der Einsatz
dieses Verfahrens mit zunehmendem Alter des untersuchten
Materials immer weniger Aussagewert hat!
Aufgabe III:
1 Zur quantitativen Bestimmung von Nitrit lässt man eine
wässrige Nitritlösung so lange in eine erwärmte angesäuerte
Kaliumpermanganatlösung einfließen, bis vollständige
Entfärbung eintritt.
1.1 Formulieren Sie die
Gesamtgleichung der Reaktion!
1.2 Bei der
manganometrischen Bestimmung von Kaliumnitrit werden 47 ml
der Nitritlösung benötigt, um 50 ml einer
Kaliumpermanganatlösung der Konzentration c(KMnO4)
= 0,1 mol /l zu entfärben.
Berechnen Sie die Masse des
Kaliumnitrits im gegebenen Lösungsvolumen und die
Stoffmengenkonzentration der Kaliumnitritlösung!
Der Gang
der Berechnungen muss klar ersichtlich sein.
2 Indophenole sind bedeutende Textilfarbstoffe. Der
Grundkörper dieser Stoffklasse ist das Indophenol, das in
angesäuerter wässriger Lösung rot ist und dann folgende
Struktur aufweist:
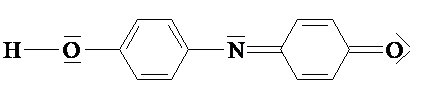
2.1 Erläutern Sie unter Verwendung von Fachbegriffen das
Phänomen "Farbigkeit" am Beispiel des Indophenols!
2.2
Versetzt man die Indophenol-Lösung mit Natronlauge bis zur
alkalischen Reaktion, so schlägt die Farbe nach Blau um.
Erklären Sie diesen Farbumschlag unter Mitverwendung
mesomerer Grenzformeln!
2.3 Aus Anilin und den nötigen
anorganischen Reagenzien soll ein Azofarbstoff synthetisiert
werden.
Erläutern Sie die Syntheseschritte unter
Mitverwendung von Reaktionsgleichungen!
3 Zur Aufklärung der lichtunabhängigen
Photosynthese-Reaktionen waren zahlreiche Meßergebnisse
nötig, wobei Grünalgen als ideale Versuchsobjekte dienten.
Ein derartiges Ergebnis ist im folgenden Diagramm stark
vereinfacht wiedergegeben:
Die Bedingungen für die
Photosynthese einer Grünalge wurden zunächst konstant
gehalten.
Dann wurde die Konzentration des
Kohlenstoffdioxids schnell sehr stark gesenkt; alle anderen
Bedingungen blieben konstant.
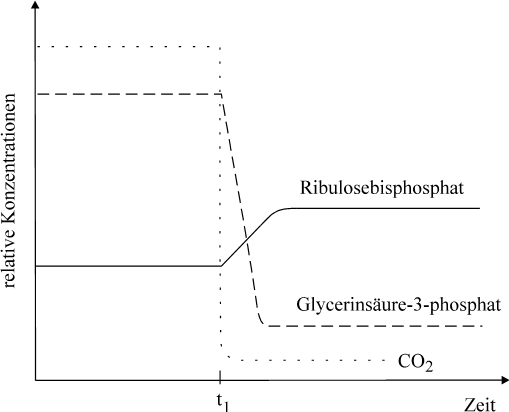
Interpretieren Sie den Verlauf der Kurven nach dem Zeitpunkt
t1, und legen Sie dar, was sich aus dem Versuchsergebnis
über den Verlauf der Dunkelreaktionen ableiten ließ!
4 Mit der Summenformel C3H6O3
lassen sich verschiedene isomere Verbindungen angeben, die
sich deutlich in physikalischen und chemischen Eigenschaften
voneinander unterscheiden.
4.1 Stellen Sie die
Strukturformeln für die Moleküle von vier offenkettigen
Isomeren mit der Summenformel C3H6O3
auf, in denen zwei C,C-Einfachbindungen enthalten sind und
ein Kohlenstoff-Atom maximal eine Hydroxylgruppe bindet. Von
Enantiomerenpaaren ist jeweils nur ein Enantiomer
wiederzugeben.
Benennen Sie die Verbindungen!
4.2 Die
vier von Ihnen unter Nr. 4.1 formulierten Verbindungen
befinden sich als Reinstoffe in vier verschiedenen Gefäßen.
Dabei ist nicht bekannt, welches Gefäß welche Substanz
enthält.
Stellen Sie tabellarisch die Ergebnisse
geeigneter Nachweismethoden zur Unterscheidung der
verschiedenen Isomeren zusammen, und leiten Sie aus den
Analyseergebnissen die Identifizierung ab!
Aufgabe IV:
1 Zwischen den physikalisch-chemischen Eigenschaften
verwandter Verbindungen und ihrer Struktur besteht ein enger
Zusammenhang.
1.1 In der folgenden Tabelle sind einige
Alkane mit ihren zugehörigen Siedetemperaturen tb
zusammengestellt:
| 4 C-Atome | 5 C-Atome | 6 C-Atome | tb °C |
|---|---|---|---|
| n-Butan | -0,5 | ||
| 2-Methylpropan | -11,7 | ||
| n-Pentan | 36,1 | ||
| 2-Methylbutan | 27,9 | ||
| 2,2-Dimethylprpan | 9,5 | ||
| n-Hexan | 68,7 | ||
| 3-Methylpentan | 63,3 | ||
| 2,2-Dimethylbutan | 49,7 |
Schreiben Sie die Strukturformeln dieser Verbindungen!
1.2 Vergleichen Sie die Siedetemperaturen
a) der Stoffe mit der gleichen Anzahl von C-Atomen und
b) der aufgelisteten n-Alkane,
und erklären Sie die in beiden Vergleichen erkennbaren Unterschiede!
1.3 Gegeben sind die beiden isomeren Alkohole 1-Pentanol (Pentan-1-ol) und 2,2-Dimethyl-1-propanol (2,2-Dimethylpropan-1-ol). Während bei 23 °C eines der beiden Isomeren unbegrenzt wasserlöslich ist, lösen sich von der anderen Verbindung nur 2,2 g in 100 ml Wasser. Ordnen Sie Löseverhalten und Alkohol einander zu, und begründen Sie Ihre Entscheidung!
2 Eine wichtige
Stoffklasse stellen die Alkene dar, die unter anderem durch
Dehydratisierung von Alkoholen hergestellt werden können.
2.1 2-Propanol (Propan-2-ol) bzw. Ethanol werden bei höherer
Temperatur unter dem katalytischen Einfluss von Säuren
unterschiedlich rasch dehydratisiert.
Erörtern Sie unter
Mitverwendung von Strukturformeln, welche der beiden
Reaktionen schneller verläuft!
Stellen Sie die
Strukturformelgleichungen für die Gesamtreaktionen auf!
2.2 Propen wird mit Wasserstoffchlorid zur Reaktion
gebracht. Von den beiden denkbaren Endprodukten entsteht nur
eines.
2.2.1 Formulieren Sie die Einzelschritte dieser
Reaktion mit Strukturformeln!
2.2.2 Begründen Sie die
Tatsache, dass bei der Reaktion in Nr. 2.2 nur eines der
beiden denkbaren Endprodukte entsteht!
3 Ein Fett
(Reinstoff) kann mit der Formel C3H5(C16H31O2)3 beschrieben
werden.
3.1 Stellen Sie eine Strukturformel für das
Molekül dieses Fettes auf!
3.2 Begründen Sie aus dem
Molekülbau den Aggregatzustand des Fettes bei
Zimmertemperatur!
3.3 Ein Hydrolyseprodukt vieler
natürlicher Fette ist die Ölsäure.
3.3.1 Erhitzt man die
bei Zimmertemperatur flüssige Ölsäure unter Luftabschluss
längere Zeit auf ca. 200 °C, so erhält man ein bei
Zimmertemperatur festes Reaktionsprodukt der Zusammensetzung
C17H33COOH.
Erklären Sie diesen Vorgang unter Mitverwendung von
Strukturformelausschnitten!
3.3.2
Mit der Ölsäure soll die Baeyersche Probe durchgeführt
werden.
Nennen Sie die Zusammensetzung des
Baeyer-Reagens!
Beschreiben Sie die Durchführung der
Probe und die Beobachtung bei der Reaktion mit Ölsäure!
4 Fette können als Ausgangssubstanzen für die Herstellung
waschaktiver Verbindungen eingesetzt werden.
4.1 Das
unter Nr. 3 gegebene Fett wird längere Zeit mit Kalilauge
gekocht.
Formulieren Sie die Gleichung für die ablaufende
Reaktion!
4.2 Erklären Sie unter Mitverwendung von
Gleichungen
a) die alkalische Reaktion einer wässrigen
Seifenlösung und
b) den Einfluss von Mineralsäuren auf
die Waschaktivität von Alkaliseifen.
4.3 Der erhöhte Bedarf
an waschaktiven Substanzen und die Nachteile herkömmlicher
Seifen haben zur Entwicklung neuer synthetischer Tenside
geführt. Geben Sie die Strukturformel eines
Alkylbenzolsulfonats an, und erläutern Sie die Auswirkung
harten Wassers auf die Waschwirkung des Tensids!
Lösung(BY95)
