Aufgabe 8
Aufgabe I/1:
1 Benzoesäure verhindert Gärung und Fäulnis von
Nahrungsmitteln und wird daher als Konservierungsmittel (E
210) eingesetzt. Ihre technische Herstellung erfolgt durch
katalytische Oxidation von Toluol mit Luftsauerstoff.
Formulieren Sie für diese Reaktion eine Reaktionsgleichung
unter Verwendung von Strukturformeln mit bindenden und
nichtbindenden Elektronenpaaren. Begründen Sie mit Hilfe von
Oxidationszahlen, dass es sich dabei um eine Redoxreaktion
handelt.
2 In einem Versuch 1 wird eine Stoffportion Benzoesäure
mit der Masse m = 0,244 g in einen Meßkolben gegeben, der
mit Wasser auf ein Volumen von V = 200 ml aufgefüllt wird.
2.1 Formulieren Sie die Reaktionsgleichung für die Protolyse
der Benzoesäure, und stellen Sie das zugehörige
Massenwirkungsgesetz auf.
Berechnen Sie den pH-Wert der
Benzoesäurelösung aus Versuch 1.
2.2 Erhöht man die
Temperatur der Lösung, so steigt deren pH-Wert.
Erläutern
Sie, welche Veränderung der Wert der Säurekonstanten der
Benzoesäure dabei erfährt.
2.3 Geben Sie an, welche
Reaktion im Protolysengleichgewicht der Benzoesäure exotherm
ist. Begründen Sie Ihre Angabe.
3 In einem Versuch 2 sollen unter Verwendung von
Natriumbenzoat und Salzsäure mit einer Konzentration von
c(HCl) = 1 mol * l-1
die gleichen Gleichgewichtskonzentrationen wie in Versuch 1
erreicht werden.
Geben Sie die für die Herstellung von
200 ml Lösung notwendige Stoffmenge n(Natriumbenzoat) an und
berechnen Sie das einzusetzende Volumen V(Salzsäure).
4 Aus geschmacklichen Gründen werden anstelle der
Benzoesäure heute oft die sogenannten „PHB-Ester“ (E 216)
als Konservierungsmittel eingesetzt.
Zeichnen Sie die
Strukturformel des p-Hydroxy-benzoesäure-propylesters mit
allen bindenden und nichtbindenden Elektronenpaaren.
5 In einem Experiment soll der Reaktionsverlauf der
Hydrolyse eines Esters am Beispiel des
Methansäuremethylesters untersucht werden.
Formulieren
Sie eine Reaktionsgleichung, und beschreiben Sie eine zur
Bestimmung der Reaktionsgeschwindigkeit dieser Esterspaltung
geeignete experimentelle Vorgehensweise.
Skizzieren Sie
allgemein den Reaktionsverlauf in einem
Konzentrations-Zeit-Diagramm.
Aufgabe I/2:
1 Eine Lösung von Saccharose in Wasser wird mit
konzentrierter Essigsäure versetzt und einige Minuten lang
bei einer Temperatur von ϑ= 85 °C gehalten.
Formulieren
Sie die Reaktionsgleichung für die dabei ablaufende Reaktion
unter Verwendung von Haworth-Formeln, und geben Sie die
Namen der Reaktionsprodukte an.
Benennen Sie den
Reaktionstyp.
2 Der vollständige Ablauf dieser Reaktion kann sowohl mit
Hilfe der Dünnschichtchromatographie als auch mit einem
Polarimeter überprüft werden.
2.1 Erläutern Sie allgemein
die Grundlagen der Dünnschichtchromatographie.
Beschreiben Sie, wie durch Einsatz dieser Methode geklärt
werden kann, ob die Reaktion vollständig abgelaufen ist.
2.2 Erläutern Sie die Funktionsweise eines Polarimeters.
Beschreiben Sie, wie unter Einsatz dieses Gerätes erkannt
werden kann, ob die Reaktion vollständig abgelaufen ist.
3 In zwei weiteren Versuchen wird mit reiner und mit der
mit Essigsäure erhitzten Saccharose-Lösung die Fehlingsche
Probe durchgeführt.
3.1 Beschreiben Sie die jeweilige
experimentelle Vorgehensweise.
Begründen Sie die zu
erwartenden Ergebnisse.
3.2 Formulieren Sie allgemein
eine Reaktionsgleichung für die der Fehlingschen Probe
zugrundeliegende Reaktion.
4 Isomaltulose ist ein Isomer der Saccharose und
unterscheidet sich von dieser allein dadurch, dass die
Monosaccharid-Bausteine α-1,6-glykosidisch verknüpft sind.
4.1 Zeichnen Sie eine Haworth-Formel des
Isomaltulose-Moleküls.
4.2 Isomaltulose reagiert mit
Fehling-Reagenz positiv.
Erläutern Sie die schrittweise
Veränderung des Isomaltulosemoleküls bei dieser Reaktion und
schreiben Sie eine Formel des entstehenden
Oxidationsproduktes.
Aufgabe II/1:
Neben dem Benzol gibt es eine Reihe weiterer Stoffe,
deren Moleküle aromatischen Charakter zeigen. Dazu gehören
Furan und Pyrrol, jedoch nicht γ-Pyran.


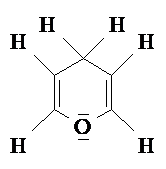
Furan Pyrrol γ-Pyran
1 Geben Sie die Hybridisierungszustände der
Kohlenstoffatome im Furan- und Pyrrol-Molekül an, und
erklären Sie den räumlichen Bau der beiden Moleküle.
Erläutern Sie, in welcher Weise das Sauerstoff- bzw. das
Stickstoffatom zur Ausbildung des aromatischen Charakters
der jeweiligen Verbindung beiträgt.
Begründen Sie,
weshalb γ-Pyran keinen aromatischen Charakter besitzt.
2 Alle drei Stoffe reagieren unter geeigneten Bedingungen
mit Wasserstoff zu den entsprechenden gesättigten,
ringförmigen Verbindungen. Die dabei freiwerdende Enthalpie
beträgt für 1 mol Furan bzw. Pyrrol jeweils ΔH ≈ 152 kJ,
für γ-Pyran ≈H 240 kJ.
Formulieren Sie für
Furan und γ-Pyran je eine Reaktionsgleichung mit
Strukturformeln, und erläutern Sie eine wesentliche Ursache
für die unterschiedlichen Reaktionsenthalpien.
3 Bei der
vollständigen Hydrierung von Pyrrol entsteht Pyrrolidin.
Zeichnen Sie dessen Strukturformel mit bindenden und
nichtbindenden Elektronenpaaren.
Vergleichen Sie die
unterschiedliche Basizität von Pyrrol und Pyrrolidin und
geben Sie dafür eine Begründung.
4.1 Die an den
Kohlenstoffatomen gebundenen Wasserstoffatome des
Pyrrolringes lassen sich z. B. durch Bromatome wesentlich
leichter substituieren als die Wasserstoffatome des
Benzolringes.
Geben Sie dafür eine mögliche Erklärung.
4.2 Formulieren Sie den entsprechenden Reaktionsmechanismus
für die Substitution eines Wasserstoffatoms, das an einem
dem Stickstoff benachbarten Kohlenstoffatom gebunden ist.
5 γ-Pyran und Brom
reagieren heftig miteinander.
Formulieren Sie eine
Reaktionsgleichung mit Strukturformeln, und geben Sie den
Reaktionsmechanismus an.
Aufgabe II/2:
1 In einem Chemiepraktikum wird unter Verwendung von Fett Seife hergestellt. Beschreiben Sie dazu einen Versuch und formulieren Sie an einem selbst gewählten Beispiel eine Reaktionsgleichung.
2 Firmen, die Tenside herstellen, machen u. a. Werbung
mit dem Spruch: „Sauberkeit aus Fett und Zucker“. Gemeint
sind Tenside, sogenannte Alkylpolyglucoside (APG), für deren
Herstellung Fettalkohole (langkettige primäre Alkohole) und
Stärke als Rohstoffe dienen.
2.1 Zeichnen Sie die
Strukturformel eines möglichen APG-Moleküls, bei dem
Fettalkohol- und Kohlenhydratbaustein glycosidisch verknüpft
sind.
2.2 Begründen Sie, weshalb APG Tensideigenschaften
besitzt. Nennen Sie zwei Vorteile des APG-Tensids gegenüber
der im Praktikum hergestellten Seife.
3 Aus Hexadecansäure (16 C-Atome) soll in mehreren
Schritten Natrium-hexadecylsulfat hergestellt werden. Dabei
wird zunächst die Carbonsäure zum entsprechenden Alkohol
hydriert und in einem weiteren Schritt dieser Alkohol mit
Schwefelsäure verestert.
3.1 Formulieren Sie für diese
beiden Reaktionen die Reaktionsgleichungen.
3.2 Geben Sie
an, wie aus dem erhaltenen Ester das gewünschte
Natriumhexadecylsulfat hergestellt werden kann, und
formulieren Sie dazu die Reaktionsgleichung.
4 Das Wäschewaschen kann in Gegenden mit hartem Wasser zu
Problemen führen. Deshalb wurde früher dem harten Wasser
Soda (Natriumcarbonat) zugesetzt, um es „weich“ zu machen.
Erklären Sie den Begriff „hartes Wasser“ und beschreiben Sie
anhand einer Reaktionsgleichung, was die Zugabe von Soda zu
hartem Wasser bewirkt.
5 Drei Reagenzgläser enthalten jeweils einige Milliliter einer wässrigen Kernseifenlösung. Zur ersten Probe wird verdünnte Calciumchlorid-Lösung, zur zweiten verdünnte Salzsäure und zur dritten Probe gesättigte Kochsalz-Lösung gegeben. Was ist jeweils zu beobachten? Erklären Sie die Beobactungen gegebenenfalls anhand von Reaktionsgleichungen.
Aufgabe III/1:
1 Die Eisenerzvorkommen im Siegerland bestehen im
wesentlichen aus Siderit (FeCO3),
aus dem im Hochofen Roheisen erschmolzen wird. Unter den
Temperaturbedingungen des Hochofens wandelt sich das
Eisencarbonat zunächst in Eisen(II)-oxid um.
1.1
Formulieren Sie hierfür eine Reaktionsgleichung. Erläutern
Sie die Vorgänge in den verschiedenen Zonen des Hochofens,
und geben Sie für die Reduktion des Eisen(II)-oxids und die
Bildung des Reduktionsmittels Kohlenstoffmonooxid jeweils
die Reaktionsgleichung an.
1.2 Berechnen Sie die
Reaktionsenthalpie für die Gewinnung von m(Eisen) = 1 t
Eisen durch Reaktion von Eisen(II)-oxid mit
Kohlenstoffmonooxid unter Verwendung der angegebenen
Tabellenwerte.
1.3 Der Massenanteil w(Eisen) einer
Erzprobe aus dem Siegerland soll durch quantitative Analyse
ermittelt werden. Dazu wird eine Probe der Masse m(Erz) =
0,315 g mit Schwefelsäure aufgeschlossen, wobei
Eisen(II)-Ionen in Lösung gehen. Bei der nachfolgenden
Titration mit einer stark schwefelsauren
Kaliumpermanganat-Lösung der Konzentration
c(MnO4–) =
0,02 mol * l-1
werden V = 20,35 ml verbraucht.
Stellen Sie die
Redoxgleichung dieser Titration auf.
Berechnen Sie den
Massenanteil w(Eisen) der Erzprobe in Prozent.
2 Das
giftige Gas Kohlenstoffmonooxid tritt auch als
Verbrennungssprodukt im Zigarettenrauch auf. Es kann durch
geeignete Prüfröhrchen nachgewiesen werden.
2.1 Die weiße
Anzeigeschicht des Prüfröhrchens enthält Iod(V)-oxid, das
unter dem Einfluss von Kohlenstoffmonooxid in braunes Iod
umgewandelt wird.
Formulieren Sie für diesen Vorgang eine
Reaktionsgleichung, und geben Sie sämtliche Oxidationszahlen
an.
2.2 Der MAK-Wert für Kohlenstoffmonooxid beträgt 30
ppm.
Definieren Sie den Begriff MAK-Wert. Geben Sie die
Masse der Kohlenstoffmonooxidportion an, die sich unter
Normbedingungen bei dieser Konzentration in einem Kubikmeter
Luft befindet.
| CO | CO2 | FeO | |
| ΔHf0 in (kJ · mol-1) | -111 | -193 | -272 |
Aufgabe III/2:
1 Durch thermische Zersetzung von Ammoniumnitrat erhält
man neben Wasserdampf gasförmiges Distickstoffmonooxid
(Lachgas).
1.1 Formulieren Sie für diese thermische
Zersetzung eine Reaktionsgleichung, und zeigen Sie, dass eine
Redoxreaktion vorliegt.
1.2 Wie groß ist die Masse der
Stoffportion m(Ammoniumnitrat), die man zersetzen Muss, um
V(Lachgas) = 1 l unter Normbedingungen zu erhalten.
1.3
Zur Erzeugung hoher Verbrennungstemperaturen wird als
Alternative zur Verbrennung in reinem Sauerstoff die
Oxidation mit reinem Lachgas vorgeschlagen. Dabei entsteht
neben den anderen Verbrennungsprodukten auch Stickstoff.
Stellen Sie die Reaktionsgleichungen für die beiden
alternativen Verbrennungen von jeweils n(Methanol) = 1 mol
auf, und berechnen Sie die Reaktionsenthalpien.
Begründen
Sie die unterschiedlichen Werte der Reaktionsenthalpien.
2 Methanol lässt sich in der Technik über eine
katalysierte Reaktion aus Kohlenstoffmonooxid und
Wasserstoff bei höherer Temperatur und unter Druck
herstellen.
2.1 Formulieren Sie für diese Synthese eine
Reaktionsgleichung.
Berechnen Sie die molaren freien
Reaktionsenthalpien ΔGR für diese Reaktion bei ϑ1= 75 °C und
bei ϑ2= 400 °C unter Verwendung der angegebenen Tabellenwerte.
2.2 Geben Sie den Temperaturbereich (Einheit: Kelvin) an, in
dem die Reaktion exergonisch verläuft.
2.3 Diskutieren
und begründen Sie die Notwendigkeit der oben angegebenen
Bedingungen bei der technischen Methanolsynthese aus
energetischer und kinetischer Sicht.
| CO | CO2 | H2O(g) | H2 | N2O | CH3OH(g) | |
| ΔHf0 (kJ · mol-1) | -111 | -393 | -242 | +82 | -201 | |
| S0 (J · mol-1* K-1) | 198 | 214 | 189 | 131 | 220 | 240 |
Lösung(BW96)
