Aufgabe 7
Aufgabe I/1:
Eine Voraussetzung für die Bildung von Karsthöhlen in Kalkgesteinen ist das Lösen von Kohlenstoffdioxid in Niederschlagswasser. Dieses Kohlenstoffdioxid kommt zum kleineren Teil aus der Luft, zum größeren Teil aus den obersten Bodenschichten. Das kohlenstoffdioxid-gesättigte Sickerwasser löst in einer Gleichgewichtsreaktion Kalk (Calciumcarbonat) unter Bildung von Hydrogencarbonat-Ionen.
1 Formulieren Sie für diese Auflösung des Kalks eine Reaktionsgleichung.
2 Deckentropfsteine aus Kalk bilden
sich dort, wo das Sickerwasser in die
kohlenstoffdioxidärmere Höhlenluft austritt.
Erklären
Sie, wie es zum Auskristallisieren von Calciumcarbonat
kommt.
Welchen Einfluss hätte eine langfristige Erhöhung
der Höhlentemperatur auf das Ausmaß der Tropfsteinbildung
unter der Berücksichtigung, dass das Lösen von
Kohlenstoffdioxid in Wasser ein exothermer Vorgang ist?
3 Bei der Reaktion von Kohlenstoffdioxid mit Wasser entsteht
in geringen Mengen die zweiprotonige Kohlensäure. Der
pKS-Wert für die 1. Protolysestufe beträgt 6,5.
3.1
Formulieren Sie für die Bildung der Kohlensäure sowie für
die 1. und 2. Protolysestufe die Reaktionsgleichungen.
3.2 Berechnen Sie ausgehend vom Massenwirkungsgesetz für die
1. Protolysestufe näherungsweise den pH-Wert einer
Kohlensäure-Lösung mit der Konzentration c = 0,01 mol * l-1.
Dabei soll die 2. Protolysestufe vernachlässigt werden.
4
Eine Wasserprobe, in der Kohlenstoffdioxid und
Hydrogencarbonat-Ionen gelöst sind, hat einen pH-Wert von
etwa 7. Fügt man zu dieser Probe etwas verdünnte Salzsäure
oder Natronlauge zu, so ändert sich der pH-Wert kaum. Bei
Zugabe einer größeren Portion Salzsäure kommt es schließlich
zu einer Gasentwicklung.
Erklären Sie diese
beiden Phänomene und geben Sie die zugehörige
Reaktionsgleichung an.
5 Beim Kalkbrennen wird Kalk
längere Zeit auf über 950 °C erhitzt. Dabei entsteht
Calciumoxid. Dieses wird anschließend mit Wasser zu
Gelöschtem Kalk umgesetzt.
Geben Sie für beide Vorgänge
die Reaktionsgleichung an. Berechnen Sie die Masse
mK(Kalkstein), die man benötigt um mL = 100 kg Gelöschten
Kalk herzustellen, wenn der Kalkstein w = 90 %
Calciumcarbonat enthält.
Aufgabe I/2:
1 Chitin, der makromolekulare Gerüststoff der Krebse
und Insekten, ist aus Acetyl-glucosamin-Bausteinen
aufgebaut. Diese sind β-1,4-glycosidisch verknüpft.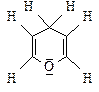
1.1 Zeichnen Sie einen Formelausschnitt des Chitins in
Haworth-Schreibweise, der zwei Bausteine umfasst.
1.2
Zeichen Sie ein Acetylglucosamin-Molekül in
offenkettiger Fischer-Projektion und kennzeichnen Sie die
asymmetrischen-C-Atome.
Entscheiden Sie, ob das
angegebene Acetylglucosamin in die Reihe der D- oder
L-Zucker gehört und erläutern Sie Ihre Entscheidung.
1.3
Vergleichen Sie die Anzahl der asymmetrischen C-Atome in der
Kettenform mit der Anzahl der asymmetrischen C-Atome in der
Ringform des Acetylglucosamin-Moleküls und begründen Sie
Ihre Aussage.
2 Bei der Hydrolyse des Acetylglucosamins
entstehen ein Zuckerderivat und eine Säure.
2.1 Formulieren Sie für diese Hydrolyse eine
Reaktionsgleichung und geben Sie den Namen der Säure an.
2.2 Aus dem Produktgemisch lässt sich die Säure durch
Destillation entfernen.
Begründen Sie dies mit Hilfe der
Struktur der Teilchen.
3 In Celluloseacetat sind
Hydroxylgruppen der Cellulose mit Ethansäure verestert. Bei
der Hydrolyse von 57,6 g dieses Esters erhält man neben
Cellulose auch 36 g Ethansäure.
3.1 Zeichnen Sie einen
Strukturformelausschnitt eines Celluloseacetatmoleküls.
3.2 Berechnen Sie die Anzahl der Estergruppen pro
Glucosebaustein.
Aufgabe II/1:
1 Phenol ist eine organische Säure, die von F. F. Runge
1834 erstmals aus Steinkohlenteer isoliert wurde. Heute ist
Phenol ein wichtiger Ausgangsstoff für die Herstellung
zahlreicher organischer Verbindungen.
1.1 Zeichnen Sie
eine Strukturformel des Phenolmoleküls mit bindenden und
nichtbindenden Elektronenpaaren.
Beschreiben Sie den Bau
des Phenolmoleküls und erläutern Sie diesen mit Hilfe des
Orbitalmodells.
1.2 Zeichnen Sie die Grenzformeln des
Phenolat-Ions.
2 Salicylsäure (2-Hydroxybenzolcarbonsäure) ist ein
Derivat des Phenols. Dieser Stoff kommt in der Rinde von
Weiden (Salix) vor. Seine schmerzstillende Wirkung war
bereits Hippokrates (460 – 377 v. Chr.) bekannt.
Technisch wird Salicylsäure nach dem Kolbe-Schmitt-Verfahren
gewonnen. Hierbei wirkt in einem ersten Reaktionsschritt
Kohlenstoffdioxid auf trockenes Natriumphenolat bei einer
Temperatur von 120 – 140 °C und bei erhöhtem Druck ein. In
einem zweiten Reaktionsschritt wird das entstandene
Zwischenprodukt mit Salzsäure umgesetzt.
2.1 Benennen,
formulieren und erläutern Sie den Reaktionsmechanismus, der
dem ersten Reaktionsschritt zugrunde liegt. Verwenden Sie
dabei Strukturformeln mit bindenden und nichtbindenden
Elektronenpaaren.
2.2 Formulieren Sie eine
Reaktionsgleichung für den zweiten Reaktionsschritt.
3 Bei der Suche nach einem wirksamen Rheumamittel
veresterte F. Hoffmann 1897 Salicylsäure mit Essigsäure
(Ethansäure) und fand so den Wirkstoff des Schmerzmittels
Aspirin®, von dem heute jährlich über 40 000 t hergestellt
werden. Auch der Ester aus Salicylsäure und Phenol ist eine
pharmakologisch wirksame Substanz.
3.1 Zeichnen Sie die
Strukturformeln der beiden Ester mit bindenden und
nichtbindenden Elektronenpaaren.
3.2 Berechnen Sie die
Massen der Stoffportionen der Edukte, die für die obige
Jahresproduktion an Aspirin® benötigt werden.
4 Salicylsäure könnte ebenso als Ausgangsstoff für die
Synthese eines Kunststoffes eingesetzt werden.
Zeichnen
Sie einen sinnvollen Strukturformelausschnitt aus dem
Makromolekül und geben Sie an, zu welcher Stoffklasse dieser
Kunststoff gehört.
Aufgabe II/2:
1 Acrylsäure (Propensäure) wird technisch durch
katalytische Oxidation von Propen mit Luftsauerstoff
hergestellt. Als Zwischenprodukt entsteht hierbei Acrolein
(Propenal).
1.1 Formulieren Sie die zugehörigen
Reaktionsgleichungen unter Verwendung von Strukturformeln
mit bindenden und nichtbindenden Elektronenpaaren.
1.2
Erläutern Sie unter Verwendung von Oxidationszahlen, dass es
sich hier-bei um Redoxreaktionen handelt.
2 Acrylsäure reagiert bei Raumtemperatur spontan mit
Brom. Hierbei entsteht ein Gemisch aus zwei Isomeren.
2.1
Formulieren Sie für diese Reaktion eine Reaktionsgleichung.
Zeichnen Sie geeignete Formeln, die den Unterschied zwischen
den beiden Isomeren erkennen lassen, und geben Sie die
eindeutigen Namen der Isomeren an.
2.2 Benennen und
formulieren Sie den Mechanismus dieser Reaktion.
3 Beim Stehenlassen an der Luft oder durch Einwirkung
einer Startersubstanz polymerisiert Acrylsäure zu einer
wasserlöslichen Masse, die z. B. als Salbengrundlage
verwendet wird.
3.1 Formulieren Sie einen
Reaktionsmechanismus für die Polymerisation von Acrylsäure.
Zeichnen Sie einen geeigneten Strukturformelausschnitt aus
dem Makromolekül.
3.2 Erläutern Sie, warum sich
Polyacrylsäure in Wasser löst.
4 In sogenannten „Ultra“-Windeln werden pulverförmige
quellbare Polymere verwendet, die ein Vielfaches ihres
Eigengewichtes an Wasser aufnehmen können und dabei ihre
Partikelform behalten. Ein solcher Superabsorber kann aus
Polyacrylsäure und einer geeigneten Menge von 1,4-Butandiol
hergestellt werden.
4.1 Zeichnen Sie einen geeigneten
Strukturformelausschnitt aus dem Makromolekül eines
Superabsorbers.
4.2 Erläutern Sie die Eigenschaften
(Wasseraufnahmevermögen, Formstabilität) des Superabsorbers.
Wie verändern sich diese Eigenschaften bei einer Erhöhung
des Anteils an Butandiol?
Aufgabe III/1:
Blei findet seit Jahrtausenden vielfältige Verwendung.
Heute werden jährlich fast fünf Millionen Tonnen Blei
gewonnen.
1 Im Röstreduktionsverfahren wird Bleiglanz
(Blei(II)-sulfid) im Luftstrom bei höherer Temperatur
geröstet. Hierbei entsteht unter anderem Blei(II)-oxid, das
in einem weiteren Prozeßschritt mit Kohlenstoffmonooxid zu
flüssigem Blei reagiert.
1.1 Formulieren Sie für die
beiden Vorgänge Reaktionsgleichungen und zeigen Sie, dass es
sich dabei um Redoxreaktionen handelt.
1.2 Das als
unerwünschtes Nebenprodukt entstehende Schwefeldioxid muss
aus der Abluft entfernt werden.
Beschreiben Sie dafür ein
technisches Verfahren.
2 In den Knochen römischer Soldaten in Britannien wurde
ein überraschend hoher Bleigehalt festgestellt, der auf die
Verwendung von bleihaltigem Essgeschirr zurückgeht.
Entscheiden Sie, ob z. B. ein Essig, der w = 6 % Ethansäure
enthält,
A mit elementarem Blei oder
B mit
oberflächlich entstandenem Blei(II)-oxid reagiert haben
kann.
Formulieren Sie zu beiden Überlegungen
Reaktionsgleichungen und entscheiden Sie unter Zuhilfenahme
Ihrer Tabelle, welcher Vorgang für das Entstehen löslicher
Bleisalze verantwortlich sein kann.
3 Metallisches Blei ist im Gegensatz zu
Kochsalzkristallen leicht verformbar.
Geben Sie dafür
eine Erklärung.
4 Bei einem Versuch soll Schwefelsäure an Bleielektroden
elektrolysiert werden. Diese überziehen sich beim Eintauchen
mit einer weißen Schicht. Im Verlauf der Elektrolyse, die
bei einer Spannung U = 5 V durchgeführt wird, ändert sich
die Farbe der Elektroden; gleichzeitig tritt an ihnen eine
Gasentwicklung auf.
4.1 Erklären Sie das Auftreten der
weißen Schicht und formulieren Sie hierzu eine
Reaktionsgleichung.
4.2 Erklären Sie die Farbänderungen
und die Gasentwicklungen während der Elektrolyse mit Hilfe
von Gleichungen und ordnen Sie die Vorgänge jeweils den
Elektroden zu.
Aufgabe III/2:
Die Gewinnung von Wasserstoff mit Hilfe von Sonnenenergie
ist seit langem Gegenstand vieler Forschungsprojekte. Ziel
ist es, den so gewonnenen Solar-Wasserstoff als
umweltfreundlichen Energieträger zu nutzen.
1 In
elektrische Energie umgewandelte Sonnenenergie kann z. B.
zur Elektrolyse einer Kaliumhydroxid-Lösung der
Konzentration c = 0,1 mol . l–1
eingesetzt werden.
Formulieren Sie die Gleichungen der
an den Elektroden ablaufenden Reak¬tionen und der
Gesamtreaktion.
Berechnen Sie die Zersetzungsspannung
ohne Berücksichtigung von Überspannungen.
2 Bei einem anderen Verfahren wird
im ersten Reaktionsschritt Schwefelsäure unter Einsatz von
Sonnenenergie bei ϑ = 800 °C zersetzt. Dabei entstehen
Schwefeldioxid, Wasser und Sauerstoff (Reaktion A).
Schwefeldioxid reagiert anschließend mit Iod und Wasser zu
Iodwasserstoff und Schwefelsäure (Reaktion B). Der Zerfall
des Iodwasserstoffs in die Elemente liefert dann den
Wasserstoff (Reaktion C).
2.1 Formulieren Sie für die
Reaktion A, B und C jeweils eine Reaktionsgleichung und
fassen Sie diese zu einer Gesamtgleichung zusammen.
2.2 Zeigen Sie unter Verwendung der angegebenen
Tabellenwerte, dass Reaktion A bei ϑ = 800 °C exergonisch
verläuft.
| H2SO4 | SO2 | H2O(g) | O2 | |
| Δ Hf (kJ . mol-1) | -814 | -297 | -242 | |
| S (J * mol-1 * K-1 | 157 | 248 | 189 | 205 |
3 Für Transport und Speicherung bietet sich unter anderem die chemische Bindung des Wasserstoffs an Trägerstoffe an. So entsteht z. B. durch Hydrierung von Toluol Methylcyclohexan, das bei Bedarf wieder zu Toluol dehydriert werden kann.
3.1 Formulieren Sie die Reaktionsgleichung für die Hydrierung von Toluol unter Verwendung von Strukturformeln.
Berechnen Sie für Normbedingungen das Wasserstoff-Volumen, das von einer Stoffportion Toluol der Masse m = 1 kg gebunden werden kann.
3.2 Die Reaktionsenthalpie *HR der Dehydrierung von Methylcyclohexan zu Toluol läßt sich mit Hilfe der angegebenen Verbrennungsenthalpien ΔHc ermitteln.
Toluol Methylcyclohexan Wasserstoff
| Toluol | Methylcyclohexan | Wasserstoff | |
| Δ HC (kJ . mol-1) | -3952 | -4606 | -286 |
Formulieren Sie die Reaktionsgleichungen für die vollständige Verbrennung der in der Tabelle angegebenen Stoffe.
Berechnen Sie die Reaktionsenthalpie ΔHR der Dehydrierung.
4 Solar-Wasserstoff könnte z.
B. in Kraftfahrzeugen anstelle von Benzin eingesetzt
werden.
Vergleichen Sie beide Brennstoffe hinsichtlich
ihrer Schadstoff-Emissionen.
Lösungen(BW95):
