Aufgabe 14
Aufgabe I:
1 Zinn(II)-chlorid findet als Reduktionsmittel in Labor
und Technik vielfältige Anwendung und ist unter anderem in
Tintenentfernern enthalten. Der Kristallwassergehalt von
Zinn(II)-chlorid soll bestimmt werden. Dazu wer-den 1,25 g
des wasserhaltigen Salzes in verdünnter Salzsäure gelöst und
60 ml einer Iod-Lösung der Konzentration c (Iod) = 0,1 mol/l zugegeben.
Bei dieser Reaktion gehen die Zinn(II)-Ionen in
Zinn(IV)-Ionen über. Anschließend wird das nicht verbrauchte
Iod mit Natriumthiosulfat-Lösung der Konzentration c
(Natriumthiosulfat) =0,05 mol/l titriert, wobei 18,9 ml der Maßlösung
verbraucht werden.
1.1 Formulieren Sie die ablaufenden
Redoxreaktionen!
1.2 Ermitteln Sie die Stoffmenge
Kristallwasser, mit der ein Mol Zinn(II)-chlorid
auskristallisiert! Der Gang der Berechnung muss klar
ersichtlich sein.
2 Manche Ester spielen als Duft- und
Aromastoffe eine wichtige Rolle. Bringt man Benzoesäure
(Phenylmethansäure) mit Ethanol und einigen Tropfen
konzentrierter Schwefelsäure zur Reaktion, so entsteht ein
Produkt mit pfefferminzartigem Geruch.
2.1 Erläutern Sie
den Mechanismus dieser Reaktion unter Mitverwendung von
Strukturformeln, und benennen Sie das organische Endprodukt!
2.2 Nennen Sie zwei Möglichkeiten, das sich
einstellende Gleichgewicht zugunsten des Esters zu
verschieben!
2.3 Für die säurekatalysierte Veresterung
wird konzentrierte Schwefelsäure, für die säurekatalysierte
Hydrolyse dagegen verdünnte Schwefelsäure eingesetzt.
Begründen Sie die Verwendung unterschiedlich konzentrierter
Schwefelsäuren für die beiden Vorgänge!
3 In lebenden
Zellen folgt der Abbau von Glucose zu Pyruvat
(Brenztraubensäure) einem gemeinsamen Stoffwechselweg.
Unterschiedlich ist jedoch die Verwertung des Pyruvats im
Stoffwechsel verschiedener Organismen.
3.1 Beschreiben
Sie, ausgehend vom Pyruvat, unter Mitverwendung von
Strukturformelgleichungen zwei Möglichkeiten des anaeroben
Abbaus bis zu den jeweiligen Endprodukten sowie die Bildung
von Acetyl-Coenzym A im aeroben Stoffwechselgeschehen! Die
Coenzyme können in der üblichen Kurzschreibweise angegeben
werden.
3.2 Bei der alkoholischen Gärung tritt als
Nebenprodukt Glycerin auf. Es entsteht durch Reduktion von
Dihydroxyacetonphosphat und Glycerinaldehyd-3-phosphat mit
NADH und anschließender Hydrolyse des Phosphorsäureesters.
3.2.1 Formulieren Sie die Strukturformelgleichungen für die
beiden Reaktionschritte, die vom Dihydroxyacetonphosphat zum
Glycerin führen!
3.2.2 Erklären Sie, weshalb bei anaerob
lebenden Hefen Glycerin nicht das alleinige Gärungsprodukt
sein kann!
4 Aus Styrol
(Phenylethen) entsteht bei Gegenwart von Radikalbildern oder
konzentrierter Schwefelsäure ein Kunststoff.
4.1
Formulieren Sie einen Reaktionsmechanismus dieser
Polyreaktion!
4.2 Polymerisiert man Styrol zusammen mit
1,4-Divinylbenzol
[(CH2 = CH)2C6H4], so entsteht ein
Produkt, das sich deutlich von Polystyrol unterscheidet.
4.2.1 Geben Sie einen kennzeichnenden
Strukturformelausschnitt für das Molekül des Copolymerisats
an
4.2.2 Geben Sie eine Eigenschaft an, in der sich
Polystyrol und das Copolymerisat unterscheiden, und
erklären Sie diesen Unterschied aus dem Vergleich der
Molekülstrukturen!
Aufgabe II:
1 Vor 50 Jahren wurde Otto Hahn für die Entdeckung der
Kernspaltung mit dem Nobelpreis für Chemie geehrt.
1.1
Bei der Spaltung eines Uran-235-Kerns durch ein Neutron ist
einer der bei-den Spaltkerne Ba-143; außerdem werden beim
Spaltvorgang drei Neutronen frei. Das entstandene Nuklid
Ba-143 geht in einigen Zerfallsschritten in das stabile
Nuklid Nd-143 über.
Formulieren Sie die Kerngleichung der
Spaltung! Ermitteln Sie Art und Zahl der Zerfälle in der
beim Ba-143 beginnenden Zerfallsreihe, und begründen Sie die
Instabilität von Ba-143!
1.2 In Brennelementen aus
angereichertem Uran bildet sich beim Betrieb eines
Kernreaktors Plutonium.
Erläutern Sie die Bildung dieses
Elements unter Verwendung von Kerngleichungen!
1.3 Das
Element Radium ist ein α-Strahler. Pro Gramm Radium werden
im Jahr 4,53 * 1018 α-Teilchen emittiert und durch diese
Kernzerfälle 0,167 ml Heliumgas (Normzustand) erzeugt.
Berechnen Sie aus diesen Werten das molare Volumen von
Helium im Normzustand! Der Gang der Berechnung muss klar
ersichtlich sein.
2 Ausgehend von Propan-1-ol und
Benzol, soll in einer dreistufigen Synthese 2-Phenylpropan
hergestellt werden. Im ersten Schritt wird der Alkohol unter
Zusatz von konzentrierter Schwefelsäure auf ca. 160 °C
erhitzt.
Alle weiteren, für die beiden anderen
Syntheseschritte benötigten Chemikalien stehen zur
Verfügung.
Erläutern Sie den Ablauf der Syntheseschritte
I und II unter Mitverwendung von Strukturformeln, und
benennen Sie die Zwischenprodukte!
Schritt III der
Synthese ist mit Angabe der notwendigen Reaktionsbedingung
in einer Strukturformelgleichung darzustellen.
3 Die
Kohlenhydrate Maltose und Saccharose zeigen beim Erwärmen
mit Fehling-Lösung unterschiedliches Verhalten.
3.1
Beschreiben Sie die Zusammensetzung der Fehling-Lösung sowie
Durchführung und Ergebnis der Fehling-Proben mit den beiden
Zuckern!
3.2 Zeichnen Sie die Strukturformeln der
Moleküle beider Zucker, und erklären Sie die Ergebnisse der
Fehling-Proben!
3.3 Auch Methanal reagiert bei der
Fehling-Probe.
Erstellen Sie für diese Reaktion die
Teilgleichungen von Oxidation und Reduktion, und fassen
Sie beide zu einer Gesamtgleichung zusammen!
Die
Komplexbildung kann vernachlässigt werden.
3.4 Eine
Saccharose-Lösung wird mit Salzsäure erwärmt.
Formulieren
Sie die dabei ablaufende Reaktion!
3.5 Eine
Saccharose-Lösung und die nach Nr. 3.4 behandelte Lösung
werden im Polarimeter untersucht.
Beschreiben Sie das
Bauprinzip des Polarimeters! Erläutern Sie das Verhalten
beider Lösungen im Polarimeter!
4 Anilin (Aminobenzol),
ein wichtiger Grundstoff der Farbstoffchemie, kann aus
Benzol über Nitrobenzol hergestellt werden.
4.1
Beschreiben Sie die Durchführung der Nitrierung von Benzol,
und erläutern Sie unter Mitverwendung von Strukturformeln
den Mechanismus dieser Reaktion!
4.2 Erklären Sie
unter Mitverwendung einer Gleichung, warum sich Anilin in
Salzsäure besser löst als in Wasser!
Aufgabe III:
1 Bei der Suche nach biologisch abbaubaren Kunststoffen
zur Lösung des Müllproblems fand man in bestimmten Bakterien
körnchenförmige Einlagerungen eines makromolekularen
Stoffes mit thermoplastischen Eigenschaften. Der Abbau
dieser Substanz liefert als Monomeres die Verbindung X der
Zusammensetzung CaHbOc, mit der die Untersuchungen I, II,
III durchgeführt werden:
I: Bei der Verbrennungsanalyse
entstehen aus 123,0 mg der Verbindung X 208,2 mg
Kohlenstoffdioxid und 85,2 mg Wasser.
II: Nach Auflösen
von 220,0 mg der Verbindung X in 5,0 g Wasser wird eine
Gefrierpunkterniedrigung von 0,79 °C festgestellt.
[Eg(Wasser) = 1,86 K kg mol–1]
III: Die Verbindung X,
eine Flüssigkeit, zeigt folgende Eigenschaften:
– Die
wässrige Lösung reagiert sauer;
– nach Zugabe
schwefelsaurer Kaliumdichromat-Lösung tritt Grünfärbung
auf;
– im Polarimeter zeigt die Lösung der Substanz
optische Aktivität;
– die Iodoformprobe verläuft positiv.
1.1.1 Ermitteln Sie aus den Ergebnissen der Untersuchung I
die empirische Formel (Verhältnisformel) der Verbindung X!
Der Gang der Berechnung muss klar ersichtlich sein.
1.1.2 Berechnen Sie die molare Masse der Verbindung X, und
geben Sie die Summenformel von X an! (Ergebnis: C4H8O3)
Der Gang der Berechnung muss klar ersichtlich sein.
1.2
Leiten Sie unter Einbeziehung der Befunde von III die
Strukturformel der Verbindung X ab, und benennen Sie diese!
Begründen Sie Ihre Entscheidung!
1.3 Stellen Sie die
Redoxgleichung für die Reaktion der Verbindung X mit
Dichromat-Ionen in saurer Lösung auf!
1.4 Beschreiben Sie
die Durchführung der Iodoformprobe! Geben Sie die
Beobachtungen an, und stellen Sie die Strukturformeln der
organischen Reaktionsprodukte auf!
1.5 Die Verbindung
X ist das Monomere eines Kunststoffs.
Zeichnen Sie einen
charakteristischen Strukturformelausschnitt
(Repetiereinheit) des Kunststoffmoleküls!
2 Der
pH-Wert von Körperflüssigkeiten wird meist in einem sehr
engen Bereich konstant gehalten. Abweichungen würden die
Funktion lebenswichtiger Enzyme beeinträchtigen.
Stellen
Sie in einem Diagramm dar, wie die Enzymaktivität vom
pH-Wert einer Lösung abhängt, und erläutern Sie diesen
Zusammenhang!
3 Die Fette A, B, und C enthalten, bezogen auf den Gesamtfettsäuregehalt, folgende Fettsäureanteile:
| Fett A | Fett B | Fett C |
|---|---|---|
| 1/3 Stearinsäure (Octadecansäure) | 2/3 Stearinsäure | 1/3 Stearinsäure |
| 2/3 Ölsäure (cis-9-Octadecensäure) | 1/3 Ölsäure | 1/3 Butansäure |
| 1/3 Ölsäure |
3.1 Geben Sie die Strukturformel eines Fettmoleküls an, das den Vorgaben zu Fett C entspricht!
3.2 Ordnen Sie die Fette A, B und C nach steigenden Schmelzbereichen und begründen Sie Ihre Zuordnung!
3.3 Vergleichen Sie die drei Fette im Hinblick auf ihre Iodzahlen, und erklären Sie die Unterschiede!
(Die Iodzahl gibt an, wie viele Gramm Iod von 100 g Fett addiert werden können.)
4 "Doebners
Violett" ist ein Triphenylmethanfarbstoff, der aus Anilin
und Benzotrichlorid (C6H5 – CCl3) entsteht.
4.1 Das in
der folgenden Gleichung angegebene Produkt ist noch nicht
der Farbstoff. Begründen Sie diese Aussage!
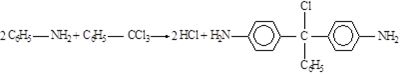
4.2
Begründen Sie unter Mitverwendung von Grenzstrukturformeln,
warum die sich an die obige Reaktion anschließende
Abspaltung des Chlorid-Ions
a) energetisch begünstigt ist
und
b) zu einem Farbstoff führt!
Aufgabe IV:
1 Perlonseide ist eine bekannte Kunstfaser. Der Ausgangsstoff für die Synthese ist ε-Caprolactam:
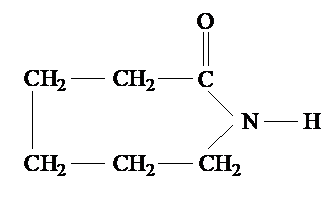
Beim Erhitzen von ε-Caprolactam mit etwas Wasser erfolgt
zunächst eine Hydrolyse und anschließend eine Polyreaktion.
1.1 Formulieren Sie die Reaktionsgleichung für die
Hydrolyse, und zeichnen Sie einen Ausschnitt des
Makromoleküls, der zwei Repetiereinheiten umfasst!
1.2
Erörtern Sie die Eignung der Perlonseide als Faser!
2
Aminosäuren sind farblose, kristalline Stoffe mit amphoteren
Eigenschaften.
Die Aminosäure Glycin (Aminoethansäure)
liegt in wässriger Lösung bei pH = 5,97 als Zwitterion vor.
Bei pH = 9,60 liegt die Hälfte der Aminosäure-Moleküle
unverändert als Zwitterion, die andere Hälfte als Anion vor.
2.1 Geben Sie die Strukturformeln von Zwitterion und Anion
an!
Berechnen Sie den pH-Wert, bei dem gilt:
n
(Zwitterion): n (Kation) = 1 :1!
2.2 Berechnen Sie den
Ks-Wert der Carboxylgruppe und den KB-Wert der Aminogruppe!
Der Gang der Berechnung muss klar ersichtlich sein.
2.3
Der Ks-Wert von Ethansäure ist 1,75 . 10–5 mol/l.
Leiten Sie ab, weshalb der Ks-Wert der Ethansäure kleiner
ist als der Ks-Wert der Carboxylgruppe des Glycins!
3 Gegeben
sind die folgenden Carbonylverbindungen:
(A) Benzaldehyd
(C6H5CHO), (B) 2,2-Dimethylpropanal,
(C) Propanal.
3.1
Stellen Sie die Strukturformeln der Moleküle der
obengenannten Stoffe auf!
Geben Sie an, mit welchem
dieser Stoffe ein Aldol gebildet werden kann, und begründen
Sie Ihre Entscheidung!
3.2 Erläutern Sie den Ablauf der
Aldolbildung unter Mitverwendung von Strukturformeln!
4 Enzyme zeigen sowohl eine Wirkungs- als auch eine
Substratspezifität.
4.1 Definieren Sie die beiden
Begriffe!
4.2 Zeichnen Sie ein beschriftetes
Energiediagramm zum Ablauf einer enzymkatalysierten
Reaktion!
Zu verwendende Symbole: E = Enzym; S =
Substrat; P = Produkt.
4.3 In einem Reaktionsgefäß I
befindet sich eine Enzymlösung, in der das Enzym kompetitiv
gehemmt ist.
In einem Gefäß II liegt eine Enzymlösung
vor, in der das Enzym allosterisch gehemmt ist.
Der Grad
der Hemmung ist in beiden Enzymlösungen gleich groß. In die
Lösungen wird zunehmend Substrat gegeben.
Erläutern Sie
den Einfluss der ansteigenden Substratkonzentration auf das
Reaktionsgeschehen in den beiden Lösungen!
4.4 Ein
Enzym kann die Oxidation der Substrate A und B katalysieren.
Dabei wird bei gleicher Ausgangskonzentration der Substrate
und bei gleicher Enzymkonzentration das Substrat A rascher
umgesetzt als das Substrat B.
Legen Sie an diesem
Beispiel den Zusammenhang zwischen Michaelis-Konstante,
Substrataffinität und Umsatzgeschwindigkeit dar!
Lösung(BY94)
