
Die Quantenzahlen
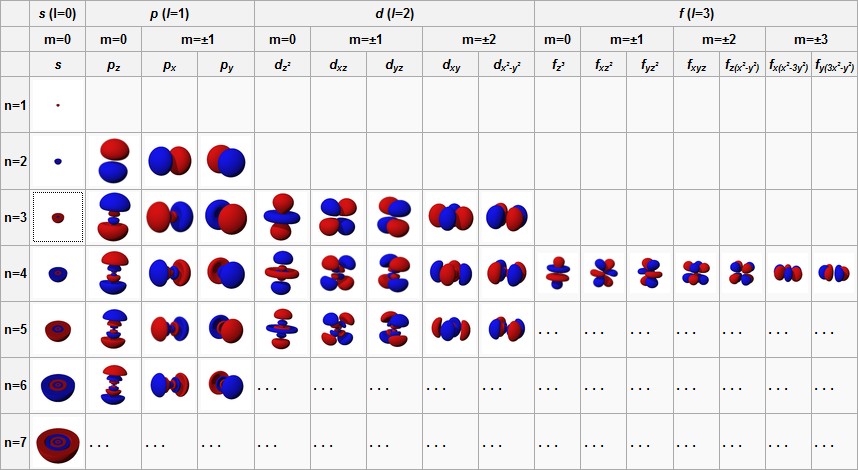
Jedes Elektron besitzt eine Satz von vier Zahlen, die man Quantenzahlen nennt und welche das Elektron vollständig beschreiben; in einem Atom können keine zwei Elektronen die gleichen vier Quantenzahlen haben. Die Hauptquantenzahl n gibt an, in welchem Hauptenergieniveau man sich befindet. n=1 entspricht der K-Schale des Bohrschen Atommodels, n=2 der L-Schale usw. Die Formel 2n² gibt an, wie viele Elektronen sich maximal in einem Energieniveau befinden können. Für n=1 sind dies 2 Elektronen, für n=2 8 Elektronen, für n=3 18 Elektronen, für n=4 32 Elektronen, für n=5 50 Elektronen, für n=6 72 Elektronen und für n=7 98 Elektronen.
Die Elektronen eines Hauptenergieniveaus lassen sich in s-, p-, d- und f-Unterniveaus unterteilen. Die Nebenquantenzahl l definiert die möglichen Niveaus. Ist l=0, liegen s-Elektronen vor, bei l=1 p-Elektronen, bei l=2 d-Elektronen und bei l=3 f-Elektronen. l kann die Werte n-n bis n-1 annehmen. Ist n=1 kann l nir den Wert 0 annehmen, bei n=2 sind die Werte l=0 und l=1 möglich, bei n=3 die Werte l=0, l=1 und l=2.
Zusammen mit der dritten Quantenzahl m wird die Form der Wahrscheinlichkeitswolke, das Orbital bestimmt. Für einen gegebenen Wert von l kann m eine beliebige ganze Zahl zwischen minus l und plus l sein. Wenn z.B. l gleich 1 ist, so kann m gleich -1, 0, oder 1 sein; das entspricht drei p-Zuständen. Man kann ausrechnen, dass es zu jedem Wert von l genau 2l+1 verschiedene Werte von m gibt.
Die vierte Quantenzahl s bezieht sich auf den Spin des Elektrons in einer Wolke. s kann den Wert -1/2 und +1/2 annehmen.